Kurzzusammenfassung
Es häufen sich Beweise, dass der aerogene Übertragungsweg eine signifikante Rolle in der Verbreitung von Influenzaviren in gemäßigten Klimazonen spielt und dass die Effizienz dieses Übertragungswegs abhängig von der Luftfeuchtigkeit ist. Trotzdem wurden die genauen Mechanismen, mittels derer die Luftfeuchtigkeit die Übertragungsfähigkeit über Aerosole beeinflussen könnte, noch nicht geklärt. Wir nehmen an, dass die Konzentration von Influenza-A-Viren (IAV) in der Luft mit der Luftfeuchtigkeit variiert, da diese die Virusinaktivierungsrate und die Größe respiratorischer Tröpfchen beeinflusst.
Um ein besseres Verständnis für die Mechanismen zu gewinnen, mittels derer die Luftfeuchtigkeit die aerogene Übertragung beeinflussen könnte, haben wir die Größenverteilung und die Dynamik von IAV, wie sie in typischen Wohn- und öffentlichen Umgebungen beim Husten ausgestoßen werden, über einen Bereich relativer Luftfeuchtigkeit (r. F.) von 10 bis 90% modelliert. Das Modell umfasst die Größenänderung Viren enthaltender Tröpfchen durch Verdunstung und die Entfernung aus der Luft durch Absinken der Partikel, durch Belüftung und Virusinaktivierung.
Die prognostizierte Konzentration infektiöser IAV in der Luft einer Wohnumgebung ist nach 10 min bei 10 % r. F. 2,4-mal höher als bei 90 % r. F., und dieses Verhältnis nimmt mit der Zeit zu. Das Absinken ist wichtig für das Entfernen größerer Tropfen, die IAV in großen Mengen enthalten, während die Belüftung und die Inaktivierung relativ betrachtet für das Entfernen solcher IAV bedeutender sind, die mit Tröpfchen < 5 µm assoziiert sind. Die Rate der Inaktivierung wächst linear mit der relativen Feuchte; bei der höchsten relativen Feuchte können durch Inaktivierung in 10 min bis zu 28 % der IAV entfernt werden.
Die Luftfeuchtigkeit ist eine wichtige Variable für die Übertragung von IAV über Aerosole, da sie sowohl die Tröpfchengröße als auch die IAV-Inaktivierungsraten beeinflusst. Unser Modell bringt ein mechanistisches Verständnis des aerogenen Übertragungswegs voran und die Ergebnisse ergänzen aktuelle Studien über die Beziehung zwischen Luftfeuchtigkeit und der Saisonabhängigkeit der Influenza. Das Aufrechterhalten einer hohen relativen Feuchte in Innenräumen sowie eine gute Belüftung können helfen, das Risiko einer IAV-Infektion zu verringern.
Studie von Wan Yang und Linsey C. Marr
In gemäßigten Klimazonen folgt Influenza A einem klar erkennbaren saisonalen Muster; dennoch ist die zugrundeliegende Ursache noch immer umstritten, obwohl sie bereits seit beinahe einem Jahrhundert untersucht wird. Die Literatur nennt zahlreiche Faktoren, die die Saisonabhängigkeit der Influenza beeinflussen können: Umweltbedingungen wie Temperatur, Luftfeuchtigkeit und UV-Strahlung; Immunfunktion; Schul- und Ferienzeiten sowie menschliches Mobilitätsverhalten und Kontaktraten [1]. Die führenden Kandidaten sind dabei die Luftfeuchtigkeit und die Temperatur [2], [3], [4]; und in Innenbereichen, in denen die Menschen 90 % ihrer Zeit verbringen, stellt die Luftfeuchtigkeit den variableren Faktor dar. Besonders in der entwickelten Welt, in der Heizungs- und Belüftungssysteme sowie Klimaanlagen (RLT-Anlagen) die Norm darstellen, liegt die Temperatur in Innenbereichen meist in einem eng definierten Bereich und hat damit nur einen begrenzten Einfluss. Aktuelle Studien an einem Meerschweinchenmodell [3], [4] deuten darauf hin, dass niedrige relative Luftfeuchtigkeiten die aerogene Übertragung von Influenza-A-Viren (IAV) fördern, bei welcher sie durch vom infizierten Wirt ausgestoßene kleine respiratorische Tröpfchen übertragen werden. Trotzdem wurden die genauen Mechanismen, mittels derer die Luftfeuchtigkeit das Überleben von Influenzaviren und ihre Übertragungsfähigkeit über Aerosole beeinflussen könnte, noch nicht geklärt.
Die Luftfeuchtigkeit kann die luftgetragene IAV-Übertragung über zwei wichtige Variablen beeinflussen. Die erste ist die Tröpfchengröße. Wenn sie aus den Atemwegen (für die 100 % r. F. angenommen wird) freigesetzt werden, erfahren Tröpfchen eine rasche Verdunstung und Schrumpfung, sobald sie mit der ungesättigten Umgebungsluft in Berührung kommen. Die letztendliche Größe eines Tröpfchens ist abhängig von der Umgebungsfeuchtigkeit. Dabei bestimmt die Größe das aerodynamische Verhalten und ob das Tröpfchen sich rasch am Boden absetzt oder lange genug in der Luft suspendiert bleibt, um möglicherweise eine Sekundärinfektion auszulösen. In früheren Untersuchungen der Verdunstung respiratorischer Tröpfchen wurde gewöhnlich mit Wasser oder einfachen salzigen Lösungen (z. B. NaCl) gearbeitet, um die Atemwegsflüssigkeit zu simulieren [5], [6]. Diese Flüssigkeit ist jedoch eine komplexe Mischung aus Wasser, Salzen und verschiedenen organischen Komponenten [7], [8], welche die Thermodynamik der Verdunstung anders beeinflussen als reines Wasser oder salzige Lösungen. Die Tröpfchengröße im Gleichgewicht wird beeinflusst durch die Oberflächenkrümmung und die Effekte gelöster Substanzen. Die Kombination dieser Faktoren wird durch die Köhler-Theorie beschrieben [9]. Während der Dampfdruck gekrümmter Oberflächen verglichen mit flachen Oberflächen größer ist, wird er in Gegenwart gelöster Substanzen verringert. Diese gegensätzlichen Effekte werden durch kleinere Tröpfchendurchmesser verstärkt und bestimmen die Tröpfchengröße im Gleichgewicht bei einer gegebenen relativen Feuchtigkeit.
Die zweite Variable, die durch die Luftfeuchtigkeit beeinflusst wird, ist die Überlebensfähigkeit von IAV [2], [10], [11], [12], [13]. Hemmes et al. [2] haben die Saisonabhängigkeit der Influenza mit der saisonalen Schwankung der relativen Feuchtigkeit in Innenräumen in Verbindung gebracht, basierend auf ihrer Untersuchung der Variation der Sterberate in Abhängigkeit der relativen Luftfeuchtigkeit. Shaman und Kohn [14] dagegen folgerten, dass die absolute Luftfeuchtigkeit (a. F.), nicht die relative Feuchtigkeit, die Saisonabhängigkeit der Influenza durch Einschränkung der Überlebensfähigkeit moduliere, aber es bleibt umstritten, ob die absolute Luftfeuchtigkeit oder die relative Luftfeuchtigkeit maßgeblich ist. Für unsere Zwecke ist eine Differenzierung zwischen diesen Größen nicht möglich, da diese Arbeit sich auf einen eng gefassten Bereich typischer Temperaturen in Innenräumen konzentriert. Schließlich ist es möglich, dass die zwei Variablen – finale Tröpfchengröße und Überlebensfähigkeit – miteinander verknüpft sind, falls die Verdunstung und die daraus resultierende Aufkonzentration gelöster Substanzen in respiratorischen Tröpfchen die Überlebensfähigkeit von IAV in Aerosolen beeinflusst.
Um die Ursachen für die Saisonabhängigkeit der Influenza ergründen zu können, ist ein verbessertes Verständnis der Übertragungsmechanismen, insbesondere auf aerogenem Wege, erforderlich. Um ein mechanistisches Verständnis der Rolle der Luftfeuchtigkeit bei der aerogenen Übertragung zu fördern, modellieren wir die Größenveränderung respiratorischer Tröpfchen und die IAV-Inaktivierung bei relativen Feuchten zwischen 10 und 90%. Basierend auf diesen Ergebnissen modellieren wir im Weiteren die Dynamik der mit einem Husten in Innenräumen ausgestoßenen Tröpfchen und illustrieren die Entstehung infektiöser IAV-Konzentrationen und -Größenverteilungen unter Berücksichtigung der Entfernung durch Absinken, Belüftung und Virusinaktivierung. Auf dieser Grundlage können wir ermitteln, in welchem Ausmaß die Luftfeuchtigkeit die Konzentration infektiöser IAV in der Luft beeinflusst.
Ergebnisse
Anfängliche Größenverteilung von Tröpfchen, die mit einem Husten ausgestoßen wurden
Wir haben sieben Studien ermittelt, die sich mit der Größenverteilung von Tröpfchen beschäftigen, die beim Husten, Niesen und Sprechen ausgestoßen werden [6], [15], [16], [17], [18], [19], [20]. Die angegebenen Werte für das geometrische Mittel (GM) des Tröpfchendurchmessers, das Größenspektrum sowie die Tröpfchenzahl variierten stark zwischen den verschiedenen Studien, wie in Tabelle 1 zusammengefasst. Da bei ungefähr 80 % der Patienten mit Influenza Husten als Symptom auftritt [21], konzentrieren wir uns auf beim Husten ausgestoßene Tröpfchen, um die Dynamik luftgetragener IAV zu demonstrieren. Beim Husten wurden Tröpfchen von nur 0,3 µm, aber auch von bis zu 2000 µm Größe beobachtet.
Tabelle 1
Bisherige Untersuchungen der Größenverteilung respiratorischer Tröpfchen
Die in den Studien angegebenen GMs rangierten zwischen 0,25 µm und 96,6 µm, je nach den angewandten Versuchsmethoden (Tabelle 1). Vier der Studien gaben die GMs in einem wesentlich engeren Bereich von 8,4 µm bis 16,0 µm an. Wir legen die Ergebnisse von Duguid [20] zugrunde, basierend auf der Zuverlässigkeit der Methoden und der Sorgfalt und Gründlichkeit der Versuchsanordnung und der Analyse. Obwohl die Studie aus dem Jahr 1946 datiert, waren ihre Ergebnisse vergleichbar mit denen aktuellerer Untersuchungen unter Verwendung modernerer Gerätschaften zur Aerosol-Charakterisierung [6,17]. Ähnlich wie bei Nicas et al. [22] ergaben unsere Experimente, dass durch Husten entstandene Tröpfchen zwischen 1 und 100 µm Größe einer lognormalen Größenverteilung folgen. Gleichung 1 beschreibt das Verhältnis:
wobei D
i der anfängliche Tröpfchendurchmesser in µm ist und z das entsprechende Quantil einer Normalverteilung mit der gleichen kumulierten Wahrscheinlichkeit. Gemäß diesem Verhältnis hat die Größenverteilung beim Husten ausgestoßener Tröpfchen ein GM von 12,9 µm und eine geometrische Standardabweichung (GSD für Geometric Standard Deviation) von 2,3 (Abbildung 1).
Abbildung 1
Logarithmischer Wahrscheinlichkeitsplot der Größenverteilung beim Husten entstehender Tröpfchen, nach Duguid [20]. D
i ist die anfängliche Tröpfchengröße in µm und z das entsprechende Quantil einer Normalverteilung mit der gleichen kumulierten Wahrscheinlichkeit.
Größenveränderung respiratorischer Tröpfchen
Ein Gleichgewichtszustand der Tröpfchengröße stellt sich nahezu augenblicklich bei der Freisetzung ein. Bei 20°C schrumpft ein Tröpfchen von 20 µm in weniger als einer halben Sekunde auf die Hälfte seines ursprünglichen Durchmessers [22]. In Tabelle 2 sind die finalen Durchmesser oder Durchmesser im Gleichgewicht (D
eq für Diameter Equilibrium) von Tröpfchen mit D
i von 0,1, 1 und 10 µm bei 10 bis 90% r. F. dargestellt. Diese wurden auf Grundlage eines Modells der Veränderung von Tröpfchen berechnet, das separate gelöste Substanzen und Volumenadditivität (GS-VA) annimmt [23]. Aufgrund des Kelvin-Effekts verdunsten kleinere Tröpfchen stärker und die Durchmesser im Gleichgewicht sind kleiner. Das Verhältnis D
eq/D
i beträgt 0,490 bei 90% r. F. für ein respiratorisches Tröpfchen mit D
i = 0,1 µm, für ein größeres Tröpfchen mit D
i = 10 µm unter den gleichen Bedingungen dagegen 0,516. Der Kelvin-Effekt ist allerdings für Tröpfchen mit D
i > 0,1 µm vernachlässigbar, und für Tröpfchen größer als 1 µm ist D
eq/D
i unabhängig von der relativen Feuchte.
Das Auftreten der Ausblühung oder Kristallbildung von NaCl, einem wesentlichen Bestandteil respiratorischer Tröpfchen, aufgrund von Wasserverlust wird bei 40 bis 50% r. F. erwartet [24]. Nach unseren Ergebnissen variiert D
eq/D
i bei 10 bis 40% r. F. um nur 3,7% (0,402–0,417), bei 50 bis 90% r. F. dagegen um 21,7% (0,424–0,516). Bei niedrigen relativen Feuchten verlieren respiratorische Tröpfchen beinahe ihr gesamtes Wasser. Zum Vergleich haben wir auch die D
eq/D
i-Verhältnisse basierend auf der Volumenadditivität berechnet. Dazu wurden experimentelle Daten zur Dehydratisierung von Tröpfchen, die NaCl enthalten [25], und zur Hydratisierung von Tröpfchen, die ein Glykoprotein enthalten [26], herangezogen. Die Abweichungen zwischen modellierten und experimentellen Ergebnissen betragen weniger als 4 % (Tabelle 2).
Tabelle 2
Tabelle 2. Größenveränderung respiratorischer Tröpfchen
Inaktivierung luftgetragener IAV
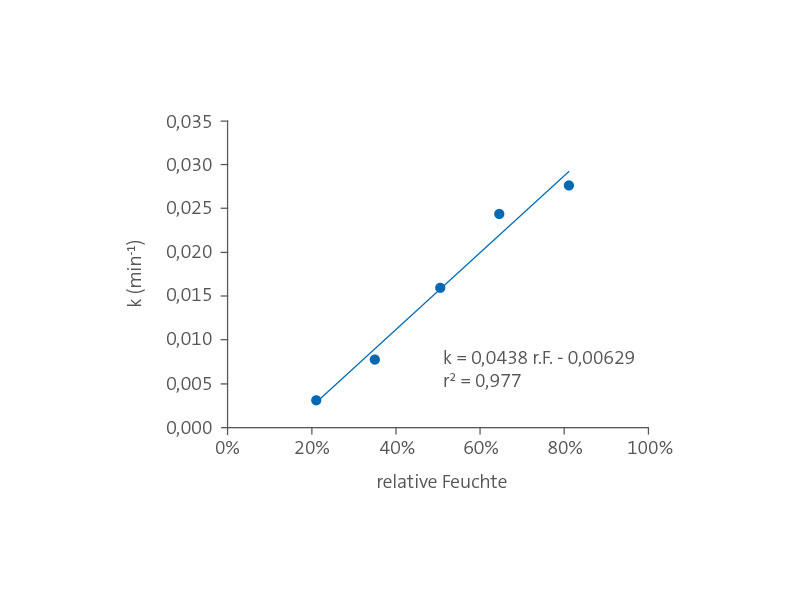
Die Überlebensfähigkeit von IAV nimmt mit der Zeit ab und wird durch Umweltvariablen wie Temperatur, Luftfeuchtigkeit und UV-Strahlung beeinflusst [12], [27]. Die aus experimentellen Daten zu luftgetragenen IAV abgeleitete Inaktivierungsrate (k) [12] steht in linearem Zusammenhang mit relativer Feuchte (Abbildung 2), entsprechend der Beziehung
mit einem r² von 0,977 und p-Werten für Modell, Achsenabschnitt und Steigung von 0,0015, 0,059 und 0,0015.
Entwicklung der Verteilung infektiöser IAV nach dem Husten
Das Modell gut durchmischter Innenraumluft, das wir für infektiöse IAV entwickelt haben, erfasst die Entfernung durch Absinken, Belüftung und virale Inaktivierung. Die Konzentration von mit Tröpfchen eines bestimmten Durchmessers D
eq assoziierten infektiösen IAV in einem Raum zum Zeitpunkt t beträgt
wobei C0 die anfängliche Konzentration von mit Tröpfchen der Größe D
eq assoziierten infektiösen IAV im Raum ist, v die Absinkgeschwindigkeit, H die Höhe des Raumes, λ die Luftaustauschrate (AER für Air Exchange Rate) unter der Annahme, dass keine Rezirkulation erfolgt, und k die Inaktivierungsrate. Entsprechend Gleichung 2 ist die Inaktivierungsrate k abhängig von r. F. und die Absinkgeschwindigkeit v ist abhängig von D
eq, welcher wiederum von r. F. abhängt. Gleichung 3 kann über alle Tröpfchengrößen integriert werden, um die Gesamtkonzentration infektiöser IAV in einem Raum zu bestimmen. Wir berechnen Ergebnisse für AERs von einem Luftaustausch pro Stunde (ACH für Air Change per Hour) und zehn ACH, typisch für Wohn- bzw. öffentliche Umgebungen [28], [29]. Der Einfachheit halber haben wir angenommen, dass die Raumhöhen in Wohnungen und öffentlichen Umgebungen wie Büros, Klassenzimmern und Krankenhäusern, in denen viele Menschen zusammenkommen und dadurch einem höheren Infektionsrisiko ausgesetzt sind, gleich sind. Die Gleichung kann für einen einzelnen rechteckigen Raum angewendet werden, ist unabhängig vom Volumen des Raums und lässt den Luftaustausch zwischen mehreren Räumen unbeachtet.
Abbildung 2
IAV-Inaktivierungsrate gegen relative Feuchte. IAV-Inaktivierungsraten (k) für jede r. F. über 1 h wurden auf Grundlage experimenteller Daten nach Harper berechnet [12].
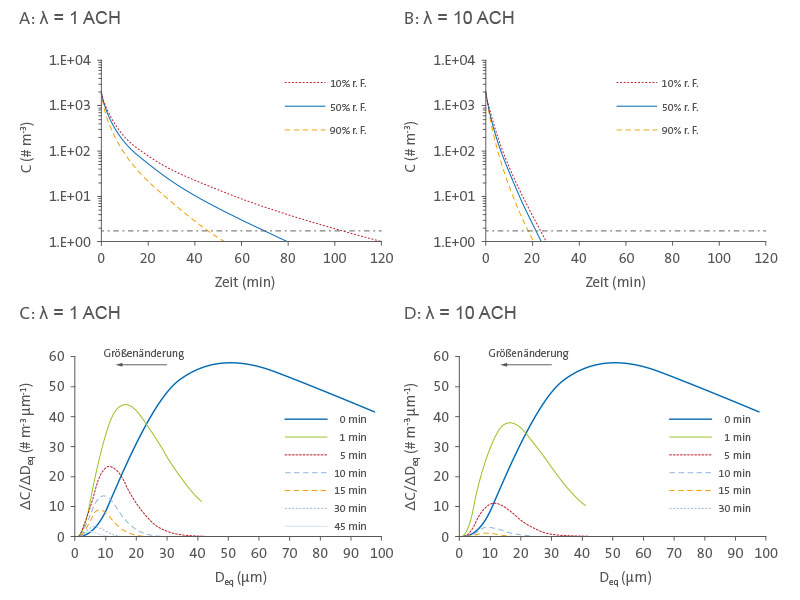
Abbildung 3
Entwicklung der Konzentrationen und Größenverteilungen infektiöser luftgetragener IAV. Zeitreihe der Konzentrationen luftgetragener infektiöser IAV nach dem Husten im Wohnumfeld (A) und öffentlichen Umgebungen (B) bei 10 bis 90% relativer Feuchte. Die horizontalen gestrichelten Linien indizieren 99,9% Entfernung. Entwicklung der Größenverteilung luftgetragener infektiöser IAV mit der Zeit nach dem Husten im Wohnumfeld (C) und öffentlichen Umgebungen (D) bei 50% relativer Feuchte.
Zeigt die Entwicklung von IAV-Konzentrationen mit der Zeit unter Betrachtung der Gesamtzahl infektiöser Viren (Abbildung 3A und 3B) und der Größenverteilung (Abbildung 3C und 3D). Nur ausgestoßene Tröpfchen mit D
i ≤ 100 µm werden betrachtet, da größere innerhalb weniger Sekunden durch Absinken entfernt werden. Nach einem einzelnen Husten in einem Raum mit gut durchmischter Luft liegt die anfängliche Konzentration infektiöser IAV unter den Annahmen dieser Studie bei 1,8 × 103 # m−3. Abbildungen 3A und 3B zeigen, dass die Gesamtzahl infektiöser IAV mit der Zeit rapide abnimmt und dass der Verlust bei höherer RH ausgeprägter ist und in öffentlichen Umgebungen stärker auftritt als im Wohnumfeld.
Wenn eine infizierte Person kontinuierlich Viren abgibt, indem sie 15-mal pro Stunde hustet [30], wird die IAV-Konzentration in einer öffentlichen Umgebung bei ungefähr 2 × 103 # m−3 liegen. Diese Konzentration ist in ihrer Größenordnung vergleichbar mit den in Krankenhäusern, Medizinischen Kliniken, Kindertagesstätten und Flugzeugen gemessenen [31], [32], [33]. Unter der Bedingung einer höheren relativen Luftfeuchtigkeit ist die Entfernung durch Absinken effektiver, da die Tröpfchen weniger stark schrumpfen, und die Inaktivierung erfolgt rascher. Die Entfernung von 99,9% der ausgestoßenen IAV erfordert im Wohnumfeld wesentlich mehr Zeit als in öffentlichen Umgebungen, was andeutet, dass die Belüftung einen wichtigen Mechanismus zur Entfernung darstellt und dass luftgetragene IAV in Umgebungen mit niedrigeren AERs über eine längere Zeit bestehen können.
Abbildungen 3C und 3D zeigen, dass ausgestoßene Tröpfchen bei 50% r. F. aufgrund von Verdunstung auf etwa die Hälfte ihres ursprünglichen Durchmessers schrumpfen. Die Verdunstung erfolgt beinahe augenblicklich [22], sodass die anfängliche Größenverteilung bei 0 min sich bis 100 µm erstreckt, alle folgenden aber bereits bei 42 µm enden (D
eq/D
i = 0,42). Dieser Prozess steigert deutlich den Anteil jener IAV, die mit kleineren Tröpfchen assoziiert sind, da die Viruskonzentration in einem Tröpfchen um den Faktor 8 ansteigt [23], wenn sein Durchmesser um die Hälfte sinkt.
Verglichen mit den anfänglichen Tröpfchen, die bei 0 min ausgestoßen werden und rasch ihre Gleichgewichts-Durchmesser erreichen, steigt beispielsweise die Anzahl von IAV mit einem Gleichgewichts-Durchmesser unter 25 µm bei 50% relativer Feuchte um den Faktor 5,2 an. In größeren Tröpfchen enthaltene IAV gehen aufgrund schnelleren Absinkens eher verloren als solche, die mit kleineren assoziiert sind.
In der Folge steigt der Anteil der IAV, die in kleineren Tröpfchen vorliegen, mit der Zeit an, was in Abbildungen 3C und 3D durch die Verschiebung des Peaks von ΔC/ΔD
eq nach links erkennbar ist. Der Durchmesser der Tröpfchen, die die meisten IAV enthalten (d. h. der Modus der Verteilung), verschiebt sich von ungefähr 50 µm bei Freisetzung auf ungefähr 16 µm nach 1 min, ungefähr 10 µm nach 10 min und ungefähr 5 µm nach 60 min im Wohnumfeld; 3D zeigt einen vergleichbaren Trend für öffentliche Umgebungen.
Feuchtigkeitsabhängigkeit und Entfernungsmechanismen
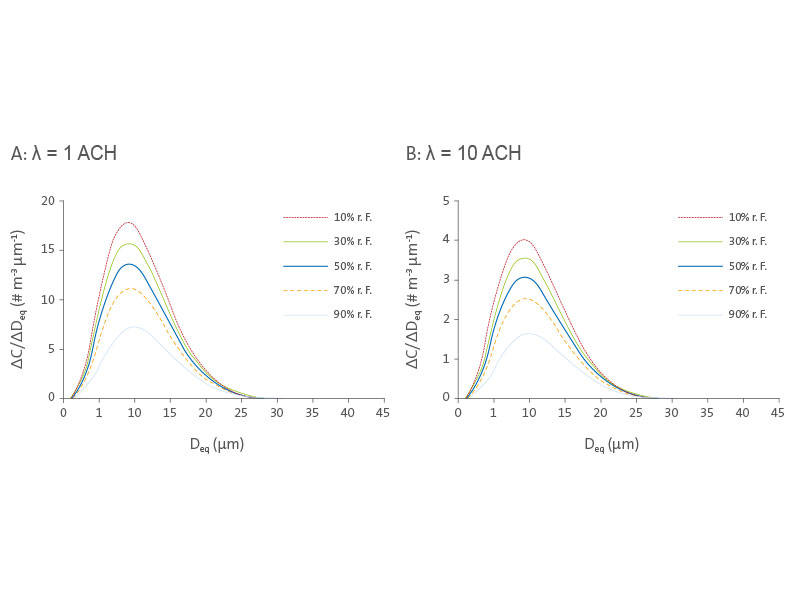
In Abbildung 4 ist der Einfluss der relativen Feuchtigkeit auf die Größenverteilungen infektiöser IAV 10 min nach dem Husten im Wohnumfeld und öffentlichen Umgebungen dargestellt. Für beide Fälle nehmen die IAV-Konzentrationen mit zunehmender r. F. über alle Größen hinweg ab, aber die Modi der Verteilung verbleiben bei etwa 9–10 µm. Die Gesamtkonzentration von IAV (d. h. die jeweilige Fläche unter der Kurve) nimmt mit steigender relativer Feuchte ab. Aufgrund dessen dauert es in Wohnumgebungen doppelt so lange, 99,9 % der IAV zu entfernen, die bei 10% r. F. ausgestoßen wurde, als bei 90% r. F. (> 100 min bei 10% r. F. verglichen mit < 50 min bei 90% r. F., wie in Abbildung 3A dargestellt).
Abbildung 4
Größenverteilungen von IAV. Größenverteilungen infektiöser IAV bei verschiedenen relativen Feuchten im Wohnumfeld (A) und in öffentlichen Umgebungen (B) mit einem Volumen von 50 m
3 und einer Höhe von 2,5 m, 10 min nach dem Husten.
Die Luftfeuchtigkeit beeinflusst sowohl das Absinken (da dieses von der Größenveränderung abhängig ist) als auch die Inaktivierung von IAV. Die relative Bedeutung dieser zwei Effekte kann durch den Vergleich der Verhältnisse der Viruskonzentrationen bei 10% r. F. gegenüber 90% r. F. zu verschiedenen Zeitpunkten illustriert werden. Diese Verhältnisse nehmen über die Zeit exponentiell zu: 2,4 bei 10 min, 5,4 bei 30 min und 16,1 bei 60 min. Würde man nur die Inaktivierung berücksichtigen, wären die Faktoren stattdessen 1,4, 2,7 und 7,3; würde man nur das Absinken berücksichtigen, wären sie 1,7, 2,0 und 2,2. Diese Verhältnisse sind unabhängig von der Belüftungsrate. Das im Vergleich mit der Inaktivierung wesentlich schmalere Spektrum von Faktoren für das Absinken (1,7–2,2 gegenüber 1,4–7,3) deutet darauf hin, dass die relative Feuchte die Inaktivierung stärker beeinflusst, besonders über längere Zeiträume (> 30 min).
Abbildung 5
IAV-Entfernungsmechanismen. Effizienzen der Entfernung infektiöser IAV durch Absinken, Belüftung und Inaktivierung im Wohnumfeld (A) und in öffentlichen Umgebungen (B) bei verschiedenen relativen Feuchten. Entfernungseffizienz durch Absinken, Belüftung und Inaktivierung als Funktion der Tröpfchengröße im Wohnumfeld (C) und in öffentlichen Umgebungen (D) bei 50% r. F. Entfernungseffizienzen sind für jeden Mechanismus separat dargestellt und addieren sich nicht auf 100%, da in der Realität mehr als ein Mechanismus auf das gleiche Virus/Tröpfchen wirken kann.
Abbildung 5 zeigt die Effektivität aller Entfernungsmechanismen – Absinken, Belüftung und Inaktivierung – unabhängig als Funktion der relativen Feuchte (Abbildungen 5A und 5B) und der Tröpfchengröße (Abbildungen 5C und 5D) 10 min nach dem Husten. Aus Abbildung 5A geht hervor, dass das Absinken in Wohnumgebungen den dominierenden Entfernungsmechanismus darstellt. Nur durch das Absinken werden innerhalb von 10 min mehr als 80% luftgetragener IAV entfernt. Die Effizienz der Entfernung nimmt über den Bereich relativer Luftfeuchte leicht von 87% auf 92% zu. Im Gegensatz dazu werden durch Belüftung nur 15% aller IAV entfernt, unabhängig von der relativen Feuchte. Die Effizienz der Entfernung durch Inaktivierung nimmt mit steigender r. F. zu und macht bei der höchsten relativen Feuchte bis zu 28 % aus. Abbildung 5B verdeutlicht, dass die Prozesse der Belüftung und des Absinkens in öffentlichen Umgebungen mit höheren AERs beide eine wichtige Rolle in der Entfernung luftgetragener IAV spielen. Bei einer AER von 10 ACH ohne Rezirkulation werden durch Belüftung 81% der luftgetragenen IAV entfernt. Das Absinken und die Inaktivierung erfolgen unabhängig von der Belüftungsrate und entfernen die gleichen Mengen an IAV wie in Wohnumgebungen.
Im Fall des Absinkens variieren die Entfernungseffizienzen für IAV als Funktion der Tröpfchengröße; das gilt nicht für die Belüftung oder die Inaktivierung. Abbildungen 5C und 5D zeigen die Entfernungseffizienz in Abhängigkeit vom Tröpfchendurchmesser bei 50% r. F., 10 min nach dem Husten, für jeden Mechanismus einzeln und für alle drei in Kombination. Da die Absinkgeschwindigkeit proportional zum Quadrat des Durchmessers ist, rangieren die Entfernungseffizienzen durch Absinken von 0,7% für Tröpfchen mit D
eq = 1 µm über 51,2% für Tröpfchen mit D
eq = 10 µm bis 98,8% für Tröpfchen mit D
eq > 25 µm. Die Effizienz der Belüftung ist für alle Größen gleich und beträgt 15% im Wohnumfeld (Abbildung 5C) und 81% in öffentlichen Umgebungen (Abbildung 5D), abhängig von der AER.
Insgesamt stellt das Absinken sowohl in Wohn- als auch in öffentlichen Umgebungen den hauptsächlichen Entfernungsmechanismus dar (Abbildungen 5A und 5B). Dieser Prozess entfernt einen überproportional großen Anteil der IAV, da er insbesondere größere Tröpfchen betrifft, welche wesentlich mehr IAV enthalten, da ihre Zahl proportional zum anfänglichen Tröpfchenvolumen oder D
3 ist. Allerdings ist das Absinken für die Entfernung von Tröpfchen < 5 µm ineffektiv, wie aus Abbildungen 5C und 5D hervorgeht.
In öffentlichen Umgebungen ist die Belüftung ein wichtiger Faktor, insbesondere für die Entfernung kleiner Tröpfchen (< 5 µm), die durch Absinken nur unzureichend erfolgt. Die Belüftung ist im Wohnumfeld für ungefähr 50% der insgesamt entfernten IAV in Tröpfchen < 5 µm verantwortlich (Abbildung 5C) und für ungefähr 80% in öffentlichen Umgebungen (Abbildung 5D). Die Inaktivierung nimmt mit zunehmender relativer Feuchtigkeit zu und erreicht ein Maximum von 28% bei 90% r. F., 10 min nach dem Husten (Abbildungen 5A und 5B). Obgleich die Entfernungseffizienz durch Inaktivierung relativ gering ist, gewinnt dieser Prozess dann an Bedeutung, wenn sowohl die Belüftung als auch das Absinken nur unzureichend wirken. Beispielsweise ist die Inaktivierung in Wohnumgebungen (Abbildung 5C) für ungefähr 50% der insgesamt entfernten IAV in Tröpfchen < 5 µm verantwortlich.
Diskussion
Eine höhere relative Feuchte fördert die Entfernung infektiöser IAV. Da größere Tröpfchen höhere Absinkgeschwindigkeiten aufweisen, ist die Entfernungsrate bei höheren relativen Feuchten mit größerem Verhältnis D
eq/D
i beschleunigt. Zusätzlich nimmt auch die Rate der IAV-Inaktivierung mit steigender r. F. zu (Gleichung 2). Gemäß unserem Modell würde die Konzentration aus einem Husten resultierender luftgetragener IAV im Wohnumfeld 10 min nach dem Husten um 10% reduziert werden, wenn die r. F. von 35 %, der mittleren relativen Feuchtigkeit in Innenräumen während der Heizperiode [30], auf 50% gesteigert werden würde, und 1 h nach dem Husten um 40%. Diese Schätzungen stimmen in der Größenordnung mit den Ergebnissen von Myatt et al. [30] überein. Deren Modell legt nahe, dass das Überleben von Influenzaviren über 15 h durch die Steigerung der relativen Luftfeuchtigkeit um 11–19% um 17,5–31,6% vermindert wird. Folglich kann das Aufrechterhalten einer angemessen hohen r. F. in Innenräumen (z. B. 50 %) die Entfernung infektiöser IAV beschleunigen und die Infektion mit Influenza verhindern oder reduzieren.
Von Interesse ist weiterhin die Bedeutung der zwei Mechanismen – Veränderung der Tröpfchengröße und Inaktivierung – als Funktion der Luftfeuchtigkeit. Shaman und Kohn [14] kamen zu dem Schluss, dass bei einer niedrigen Luftfeuchtigkeit die absolute Feuchte die Übertragung von Influenza durch die Beeinflussung der Überlebensrate der Viren moduliert statt durch die Steigerung der Produktion luftgetragener Tröpfchenkerne. Wir sind zu dem Ergebnis gekommen, dass respiratorische Tröpfchen bei 90% r. F. auf die Hälfte ihrer ursprünglichen Durchmesser schrumpfen würden und bei 10% r. F. auf ca. zwei Fünftel. Dementsprechend fallen Veränderungen der Tröpfchengröße bei ungesättigten relativen Feuchtigkeiten offenbar dramatisch aus, und Variationen aufgrund unterschiedlicher relativer Feuchtigkeiten erscheinen relativ trivial. Unsere Analyse zeigt, dass die Entfernung durch Inaktivierung stärker mit der r. F. variiert als die Entfernung durch Absinken. Dies könnte erklären, warum Shaman und Kohn [14] eine statistisch signifikante Beziehung zwischen absoluter Feuchtigkeit und dem Überleben, nicht aber der Übertragung von Influenza feststellen konnten. Allerdings bedeutet das nicht, dass das Schrumpfen von Tröpfchen als Reaktion auf ungesättigte relative Luftfeuchte für die Übertragung von Influenza unbedeutend wäre, sondern lediglich, dass dieser Effekt nicht so offenkundig ist wie die ausgelöste Änderung der Überlebensfähigkeit.
Wir haben die relative Bedeutung der drei Entfernungsmechanismen demonstriert. Durch Absinken können innerhalb von 10 min mehr als 80% der beim Husten ausgestoßenen Tröpfchen entfernt werden; dieser Mechanismus ist jedoch nur für größere Tröpfchen effektiv, während die kleineren (< 5 µm) weiterhin in der Luft verbleiben. Belüftung dagegen kann durch einfachen Luftaustausch Tröpfchen aller Größen entfernen. Aus diesem Grund erleichtern höhere AERs die Eliminierung Viren enthaltender Tröpfchen aus Innenräumen, besonders, um die mangelnde Effizienz der Entfernung kleiner Tröpfchen durch Absinken auszugleichen. Diese Beobachtung rechtfertigt auch die Forderung, in öffentlichen Umgebungen höhere AERs aufrechtzuerhalten (z. B. 12 ACH in Wartebereichen in Krankenhäusern [34]). Die Effizienzen der Entfernung durch Virusinaktivierung sind relativ gering (d. h. 0–28% in 10 min bei alleiniger Betrachtung der Inaktivierung). Diese Schätzungen basieren allerdings auf Versuchsdaten von Harper [12], welche niedrigere Inaktivierungsraten von 0,0031–0,028 min
-1 bei 20–81% r. F. angeben als die 0,0073 ± 0,0031 min
-1 bei 15–40% r. F. und 0,091 ± 0,24 min
-1 bei 50–90% r. F., wie sie von Hemmes [2] berichtet wurden. Unter Verwendung der Daten von Hemmes [2] wären die entsprechenden Entfernungseffizienzen größer: 7,0% bei 15–40% r. F. und 59,8% bei 50–90% r. F. Damit könnte die Virusinaktivierung eine prominentere Rolle spielen, je nach der tatsächlichen Inaktivierungsrate.
Überlebensfähigkeit, Saisonabhängigkeit und Feuchtigkeitsabhängigkeit von IAV
Es wurden experimentelle und/oder theoretische Modelle zur Vorhersage der Überlebensfähigkeit luftgetragener IAV als Funktion der Luftfeuchtigkeit konstruiert [14], [35], doch eine weithin anerkannte mechanistische Erklärung für diese Beziehung fehlt. Untersuchungen des Einflusses der Luftfeuchtigkeit stimmen überein, dass die Überlebensfähigkeit von IAV bei niedrigen relativen Feuchten größer ist. Allerdings ermittelten Hemmes [2], [11] und Harper [12] höhere Inaktivierungsraten sowohl bei mittleren als auch bei hohen relativen Feuchten, während Shechmeister [10] und Schaffer et al. [13] höhere Inaktivierungsraten nur bei mittleren, nicht aber bei hohen relativen Feuchtigkeiten beobachteten. Diese Diskrepanz könnte mit der unterschiedlichen Zusammensetzung der in den jeweiligen Experimenten verwendeten Medien zusammenhängen. Alle Medien enthielten Salze (ca. 0,5–3%); allerdings enthielten die in den zwei erstgenannten Experimenten verwendeten Medien deutlich mehr Protein als die in den zwei letztgenannten. Hohe Salzkonzentrationen haben sich als schädlich für die Vogel-IAV erwiesen [36]. Wenn das Wasser in den Tröpfchen verdunstet, steigen die Konzentrationen gelöster Substanzen an, was zu einer Beschleunigung der IAV-Inaktivierung führen kann. Ein NaCl-Tröpfchen kann allerdings am Ausblühungspunkt (45–48% r. F.) sein gesamtes Wasser verlieren und auskristallisieren [45], wodurch der negative Effekt gelöster Salze bei niedrigen relativen Feuchten eliminiert wird.
Dieser Effekt ist in Tabelle 2 erkennbar, aus der hervorgeht, dass D
eq/D
i bei einer r. F. ≤ 40 % nur wenig variiert. Die Kombination aus steigenden Salzkonzentrationen gefolgt von der Ausblühung mit sinkender r. F. könnte den von Shechmeister [10] und Schaffer et al. [13] beobachteten Trend erklären.Zudem ergab eine Studie über die aerogene Übertragung zwischen Meerschweinchen [3], dass die Übertragung bei 5°C umgekehrt proportional zur r. F. erfolgt, obwohl in Experimenten bei 20°C bei 50% r. F. eine niedrigere Übertragungsrate beobachtet wurde als bei 65% r. F. Bei 80% relativer Luftfeuchtigkeit wurde eine Übertragung von 0% gemessen; das widersprüchliche Ergebnis bei 50% oder 65% könnte demnach auf der stochastischen Natur von Infektionen beruhen. Wenn höhere Übertragungsraten zumindest teilweise auf höheren Überlebensfähigkeiten beruhen, stimmen diese Ergebnisse offenbar mit dem von Hemmes [2], [11] und Harper [12] berichteten Trend überein. Unter Berücksichtigung der vergleichbaren Zusammensetzung der von infizierten Menschen und Meerschweinchen ausgestoßenen Tröpfchen (d. h. Salze und Proteine) erscheint die Annahme gerechtfertigt, dass IAV, die in von Menschen ausgestoßenen Tröpfchen vorliegen, bei höheren relativen Feuchten einer gesteigerten Inaktivierung unterliegen.
Die Beziehung zwischen IAV-Überlebensfähigkeit und relativer Feuchte könnte mit Interaktionen zwischen den Komponenten respiratorischer Tröpfchen (Glykoproteine, Salze und Wasser) und dem Virus zusammenhängen, die abhängig von der Konzentration sind, welche durch das Maß an Verdunstung bestimmt wird, das wiederum von der Umgebungsfeuchtigkeit abhängt. Proteine können die Wirkung von Salzionen auf IAV verkomplizieren, indem sie mit den Salzionen interagieren und deren schädlichen Effekten so entgegenwirken. Studien haben ergeben, dass IAV in der Gegenwart von Atemwegsschleim wesentlich länger infektiös bleiben [37], [38]. Weitere Untersuchungen solcher Interaktionen und der möglichen Bildung von Komplexen in respiratorischen Tröpfchen als Reaktion auf Änderungen der Luftfeuchtigkeit auf molekularer Ebene sind erforderlich.
Wir spekulieren, dass die Saisonabhängigkeit der Influenza in gemäßigten Klimazonen mit dem Gipfelpunkt im Winter durch die intensivere Verdunstung von Tröpfchen bei niedrigen relativen Feuchtigkeiten gefördert wird, welche zu höher konzentrierten IAV in der Luft führt, kombiniert mit der Abhängigkeit der Überlebensfähigkeit aerosolisierter IAV von der relativen Feuchte. Bei einer r. F. von 90% schrumpfen Tröpfchen auf etwa die Hälfte, wobei gebundene IAV zurückbleiben, die lange genug in der Luft verbleiben können, um Sekundärinfektionen auszulösen. Diese These wird durch unsere kürzlichen Messungen größenaufgelöster Konzentrationen luftgetragener IAV gestützt: 64% der in einer Kindertagesstätte, einem Gesundheitszentrum und Flugzeugen detektierten IAV-Genome waren mit kleinen Partikeln < 2,5 µm assoziiert (15% im Bereich 0,25–0,5 µm, 10% im Bereich 0,5–1,0 µm und 28% im Bereich 1,0–2,5 µm) [33].
Diese Partikel können für Stunden oder Tage in der Luft verbleiben. Da an einer Infektion viele Faktoren beteiligt sind, ist noch immer unklar, welche Tröpfchengröße am wahrscheinlichsten Influenza überträgt, ebenso wie die Frage, welche Region der menschlichen Atemwege am anfälligsten für eine Influenzainfektion ist. Wenn wir jedoch lediglich die Effizienz der Ablagerung in den menschlichen Atemwegen berücksichtigen, so beträgt die Tröpfchengröße mit der höchsten Ablagerungseffizienz (∼ 95%) bei zusammenfassender Betrachtung aller Regionen der Atemwege ungefähr 5 µm. Die Ablagerungseffizienz solcher Tröpfchen in den tracheobronchialen und alveolaren Regionen liegt bei ungefähr 10%; der Großteil der Tröpfchen setzt sich in der nasopharyngealen Region ab. Die Tröpfchengröße mit der höchsten Ablagerungseffizienz (∼ 17%) in den tracheobronchialen und alveolaren Regionen beträgt ungefähr 2,5µm [39]. Damit haben diese kleineren Tröpfchen ein größeres Potenzial, sowohl in der Luft suspendiert zu bleiben als auch sich tiefer in den menschlichen Atemwegen abzulagern.
Bei extrem hohen relativen Feuchtigkeiten, beispielsweise nahe 100 % in tropischen Regionen zur Regenzeit, schrumpfen die Tröpfchen weniger stark (D
eq/D
i = 0,927 bei 99% r. F. und 0,755 bei 98% r. F. nach unseren Berechnungen). Dadurch sinken die Tröpfchen schneller ab und der aerogene Übertragungsweg verliert relativ an Bedeutung. Aufgrund der geringeren Verdunstung bleiben die Konzentrationen von Salzen und Glykoproteinen vergleichbar mit denen in den Atemwegen, welche für das Virus unschädlich sind. Wie von Lowen et al. [40], [41] vorgeschlagen, könnten in den Tropen andere Übertragungswege (z. B. über Kontakt) dominieren. Lowen et al. legten außerdem nahe, dass die Abhängigkeit des aerogenen Übertragungswegs von relativer Feuchte und Temperatur zu der in gemäßigten Klimazonen beobachteten Saisonalität beiträgt, während die Unabhängigkeit der Übertragung durch direkten Kontakt von diesen zwei Variablen das ganzjährige Vorkommen der Influenza in tropischen Regionen bedingt. Unsere Analyse stützt diese Hypothese.
Grenzen des Modells
Unser Modell stößt an mehrere Grenzen. Erstens ist das verwendete Modell zur Vorhersage von Tröpfchengrößen im Gleichgewicht zwar in Experimenten unter Verwendung von Partikeln aus NaCl und bovinem Serumalbumin (BSA) bestätigt worden [23]; dennoch ist eine weitergehende Verifizierung mit Atemwegsflüssigkeit erforderlich, da diese eine so komplexe Zusammensetzung aufweist. Außerdem ist die Zusammensetzung der Atemwegsflüssigkeit von der ausstoßenden Region (Nase oder Mund) und der Herkunft der Flüssigkeit (obere oder untere Atemwege) abhängig, ebenso wie vom Stadium der Infektion. Entzündete Atemwege sondern größere Mengen von Schleim ab, der wiederum die Trockenmasse der Atemwegsflüssigkeit erhöht [42]. Aus diesem Grund könnte die Gleichgewichtsgröße ausgestoßener Tröpfchen basierend auf der Zusammensetzung unter gesunden Bedingungen größer sein, als hier angegeben. Andererseits weist Speichel wesentlich geringere Konzentrationen an Salzen und Glykoproteinen auf [43], [44], sodass beim Husten ausgestoßene Tröpfchen durch Verdünnung mit Speichel eine geringere Trockenmasse haben könnten.
Zweitens beruht das Modell auf begrenzten Daten, die aus Laborexperimenten gewonnen wurden. Die Untersuchung von Harper [12] und andere Studien zur IAV-Überlebensfähigkeit in aerosolisierten Tröpfchen [10], [11], [13] sind nicht nur Jahrzehnte alt, es wurden auch in keiner von ihnen die Inaktivierungsraten als Funktion der Tröpfchengröße untersucht. Für eine bessere Vorhersage des Schicksals luftgetragener IAV sind genauere Messungen des Einflusses der Größe respiratorischer Tröpfchen auf die IAV-Überlebensfähigkeit erforderlich.
Drittens haben wir für die Berechnung der IAV-Konzentration ein gut durchmischtes Raummodell ohne Rezirkulation zugrunde gelegt. Dieses Modell geht davon aus, dass Tröpfchen sich sofort, kontinuierlich und gleichmäßig im Raum verteilen. Lai und Cheng [45] zufolge dauert es jedoch mindestens 270 Sekunden, bis sich Tröpfchen von 10 µm Größe bei 5 ACH gleichmäßig verteilt haben. Bei niedrigeren AERs könnte es noch länger dauern, bis sich das System gut durchmischt hat. Genauere Berechnungen könnten möglicherweise unter Einsatz der numerischen Strömungsmechanik erzielt werden. Weiterhin könnte die Belüftung eine relativ geringere Rolle in der Entfernung von Viren verglichen mit dem Absinken und der Inaktivierung einnehmen, falls die Rezirkulation einen großen Teil der AER ausmacht und Viren nicht aus der RLT-Anlage entfernt werden.
Schließlich demonstriert diese Untersuchung die Entwicklung von IAV-Konzentrationen, die durch Husten ausgelöst wurden. Andere Aktivitäten wie normale Atmung, Sprechen und Niesen wurden nicht berücksichtigt. Fabian et al. [46] ermittelten, dass IAV-RNA (d. h. potenziell infektiöse IAV) mit einer Rate von < 3,2 bis 20 RNA-Partikeln min
-1 mit der ausgeatmeten Luft infizierter Patienten abgegeben wurde. Diese Tröpfchen waren kleiner als die beim Husten ausgestoßenen; über 87% hatten einen Durchmesser von < 1 µm. Für bei der normalen Atmung abgegebene IAV wäre die Konzentration luftgetragener IAV aufgrund der kleineren Tröpfchengröße demnach geringer, und ihre Entfernung würde stärker von der Belüftung und der Inaktivierung abhängen als vom Absinken. IAV können auch beim Sprechen ausgestoßen werden, aber unseres Wissens sind in der Literatur aktuell keine detaillierten Versuchsdaten zu diesem Phänomen verfügbar.
Die Größenverteilung der Tröpfchen beim Sprechen ist vergleichbar mit der beim Husten (Tabelle 1). Folglich ist anzunehmen, dass das Modell für beim Sprechen generierte IAV vergleichbare Ergebnisse hinsichtlich der Entfernungseffizienz verschiedener Mechanismen liefern würde. Niesen ist eine weniger häufige klinische Manifestation der Influenza als Husten, welcher bei ungefähr 80% der Patienten auftritt [21], [46], [47], [48]. Der Hauptunterschied zwischen Niesen und Husten liegt darin, dass Ersteres wesentlich mehr Tröpfchen generiert, besonders viele kleinere. Hier wären die anfänglichen IAV-Konzentrationen höher und die Belüftung würde eine größere Rolle in ihrer Entfernung einnehmen.
Methoden
Gleichungen zur Erzeugung der anfänglichen Größenverteilungen respiratorischer Tröpfchen
Aus den Daten zur Größenverteilung beim Husten ausgestoßener Tröpfchen [20] haben wir die Tröpfchenzahlen mit D
i ≤ 100 µm berücksichtigt. Der z-Wert der Standardnormalverteilung mit der gleichen kumulierten Wahrscheinlichkeit wie für Tröpfchen mit einem Durchmesser D
i wurde unter Anwendung der NORMSINV-Funktion in Excel 2007 berechnet. Die Gleichung der linearen Regression nach der Methode der kleinsten Quadrate für z und lnD
i ist in Gleichung 1 und Abbildung 1 dargestellt.
Es wurde dann die anfängliche Größenverteilung der Tröpfchen (≤ 100 µm) beim Husten mit der NORMSDIST-Funktion in Excel 2007 generiert:
dabei ist n
i die Tröpfchenzahl in der i-ten Größenklasse (5-µm-Schritte in dieser Studie), N ist die Gesamtzahl an Tröpfchen ≤ 100 µm (d. h. 4775 nach Duguid [20]) und z
i,upper sowie z
i,lower sind die oberen und unteren z-Werte der i-ten Größenklasse.
Modell zur Berechnung der Größe respiratorischer Tröpfchen im Gleichgewicht
Die Tröpfchengrößen im Gleichgewicht, die durch Verdunstung entstehen, wurden basierend auf der Köhler-Theorie unter Berücksichtigung der zwei Hauptbestandteile von Atemwegsflüssigkeit geschätzt: anorganischen Salzen und Glykoproteinen. Effros et al. [7] haben die Konzentrationen (Mittelwert ± Standardfehler) der wesentlichen Elektrolyte als 91±8 (Na), 60±11 (K) und 102±17 (Cl) mM, von Glykoproteinen als 76,3±18.2 g L
-1 und von Laktat als 44±17 mM ermittelt. Wir nehmen daher an, dass Atemwegsflüssigkeit 150 mM (8,8 g L
-1) NaCl enthält, um die anorganischen Komponenten zu repräsentieren, und insgesamt 76 g L
-1 an Proteinen (TP für Total Protein) zur Modellierung der organischen Komponenten, wie es auch Nicas et al. getan haben [22].
Das von Mikhailov et al. hergeleitete GS-VA-Modell [23] basiert auf den physiochemischen Eigenschaften (praktische osmotische Koeffizienten, Molekulargewichte und Dichten der enthaltenen gelösten Substanzen usw.) des Tröpfchens und dem Kelvin-Effekt. Die Ergebnisse ihrer Modellierung von Partikeln mit 90% BSA (Trockenmasseanteil) stimmten gut mit Versuchsdaten zur Dehydratisierung gemischter NaCl-BSA-Partikel überein. Aufgrund der vergleichbaren Zusammensetzung von Atemwegsflüssigkeit (89,6% TP in der Trockenmasse) mit ihren NaCl-BSA-Partikeln haben wir ihr GS-VA-Modell zur Berechnung der Größe respiratorischer Tröpfchen im Gleichgewicht herangezogen.
Das GS-VA-Modell sagt das Gleichgewicht der relativen Feuchte mit einem bestimmten Tröpfchendurchmesser (D
eq) folgendermaßen voraus:
dabei ist σ die Oberflächenspannung (angenommen als die von Wasser wie von Mikhailov et al. praktiziert [23], also 0,072 N m
-1); M ist die molare Masse, die Indizes w und y beziehen sich auf Wasser bzw. die Komponente y (entweder NaCl oder TP), und M
w = 18 g mol
-1, M
NaCl = 58,4 g mol
-1, M
TP ≈ M
BSA = 66,56 x 10
³ g mol
-1; ρ, ρ
w und ρ
y sind die Dichten des gesamten Tröpfchens, von Wasser bzw. von Komponente y (ρ
NaCl = 2165 kg m
-3, ρ
TP ≈ ρ
BSA = 1362 kg m
-3), R ist die ideale Gaskonstante; T ist die absolute Temperatur (298 K in dieser Studie); D
eq ist der Durchmesser eines Tröpfchenrests im Gleichgewicht bei gegebener r. F.; D
m,s ist der massenäquivalente Durchmesser eines Partikels aus den gelösten Substanzen in Trockenform; υ
y ist der stöchiometrische Dissoziationsgrad von Komponente y, υ
NaCl = 2 und υ
TP = υ
BSA = 1; Φ
y ist der molare oder praktische osmotische Koeffizient der Komponente y und beschreibt die Nicht-Idealität der Lösung; und x
s,y ist der Massenanteil der Komponente y (x
NaCl = 0,104 und x
TP = 0,896 in dieser Studie). Bei gegebenem D
i kann der massenäquivalente Durchmesser D
m,s berechnet und als Ausgangswert für die weitere Berechnung von D
eq mit seiner Gleichgewichts-Feuchte genutzt werden.
Virusinaktivierungsrate
Harper [12] hat eine detaillierte Untersuchung der Überlebensfähigkeit luftgetragener IAV über ein breites Spektrum an relativen Feuchten und Temperaturen durchgeführt. In diesem Experiment wurden mit einem Zerstäuber Tröpfchen mit IAV erzeugt und in eine sich 3 Mal pro Minute drehende Trommel gegeben; die Ergebnisse wurden korrigiert in Bezug auf den physikalischen Verlust durch Absinken und andere Ablagerungsmechanismen. Wir haben seine Daten zur Überlebensfähigkeit bei 20–24,5°C, typischen Temperaturen in Innenbereichen, bei relativen Feuchten zwischen 20% und 81% zur Berechnung der Inaktivierungsraten als Funktion der r. F. verwendet (Tabelle 3). Da die Verweildauer von Luft in Innenbereichen typischerweise maximal 1–2 h beträgt, haben wir nur die Überlebensdaten der ersten Stunde des Experiments berücksichtigt.
Tabelle 3
Inaktivierung luftgetragener IAV bei 20–24,5°C über 1 h
Wir haben die Überlebensfähigkeit unter der Annahme quantifiziert, dass die Inaktivierung luftgetragener IAV nach Freisetzung einem Prozess erster Ordnung folgt, sodass
abei ist N die Anzahl freigesetzter IAV, t ist die Zeit, und die Rate der Inaktivierung (k) ist
dabei sind N
0 und N
t die IAV-Zahlen bei t = 0 und zum Zeitpunkt t, S
t ist die Überlebensrate oder Überlebensfähigkeit (%) zum Zeitpunkt t. Dementsprechend haben wir unter Verwendung der SLOPE-Funktion in Excel 2007 k für jede relative Feuchte aus den von Harper berichteten S
t-Daten [12] berechnet (Tabelle 3). Die Gleichung der linearen Regression nach der Methode der kleinsten Quadrate zwischen k und r. F. ist in Gleichung 2 dargestellt.
Konzentration infektiöser IAV in Innenräumen
Das Modell zur Schätzung der Konzentration infektiöser IAV nimmt an, dass sie mit einem Husten ausgestoßen und augenblicklich innerhalb des gesamten Innenraums gut verteilt werden, sodass die IAV-Konzentrationen im Raum und in austretender Luft identisch wären. Die Entfernung von IAV kann durch Belüftung, Inaktivierung und Absinken erfolgen. Es wird angenommen, dass die Größenveränderung der Tröpfchen zum Zeitpunkt Null abgeschlossen ist; für diese Berechnung wurde D
eq verwendet. Angenommen, dass die eingelassene Luft keine IAV enthält, kann die Veränderung der IAV-Konzentration mit der Zeit folgendermaßen modelliert werden:
dabei ist C die Konzentration infektiöser IAV im Raum und in der ausströmenden Luft (# m
-3); v ist die Geschwindigkeit des Absinkens, berechnet mit dem Stokesschen Gesetz basierend auf D
eq; H wird in dieser Studie als 2,5 m angenommen; λ ist die Luftaustauschrate unter der Annahme, dass keine Rezirkulation erfolgt; und k ist die Inaktivierungsrate, berechnet nach Gleichung 2. Zum Zeitpunkt Null werden IAV durch Husten freigesetzt, und die anfängliche Konzentration von mit Tröpfchen verbundenen IAV in der i-ten Größenklasse, C
i,0 (# m
-3) ist
dabei ist 0,778 die anfängliche Überlebensrate (d. h. die durchschnittliche Überlebensrate nach 1 s gemäß den Ergebnissen von Harper [12]); 6,3 x 10
-3 ist die IAV-Konzentration in Atemwegsflüssigkeit (# µm
-3), ermittelt unter der Annahme, dass Atemwegsflüssigkeit die gleiche Konzentration an IAV enthält wie Nasenspülungen infizierter Personen (6,3±0,36 x 10
6 mediane Tissue Culture Infectious Dose (TCID
50) mL
-1 [49]) und dass 1 TCID
50 1000 Viruspartikeln entspricht [50]; der erste Term in Klammern ist das durchschnittliche Tröpfchenvolumen für die Klasse; D
i,upper und D
i,lower sind der obere bzw. untere Durchmesser der i-ten Größenklasse (µm); n
i ist die Tröpfchenzahl für die i-te Größenklasse, ermittelt durch Gleichung 4; und V ist das Raumvolumen (angenommen als 50 m
3). Die Lösung für C ergibt sich aus Gleichung 3.
Effizienz der Entfernung durch Absinken, Belüftung und Inaktivierung
n dieser Studie meint Entfernungseffizienz den Prozentsatz der IAV, die zu gegebenem Zeitpunkt und bei gegebener relativer Feuchte durch einen bestimmten Mechanismus entfernt wurden (d. h. Absinken, Belüftung, Inaktivierung oder eine Kombination daraus). Die Entfernungseffizienzen durch Absinken (E
settling), Belüftung (E
vent) und Inaktivierung (E
inactivation) sowie die gesamte Entfernungseffizienz (E
total) in Abbildung 5 werden berechnet in den Gleichungen 10–13:
Kommentar von
Dr. med. Walter J. Hugentobler
In dieser Studie modellierten die Autoren die Eliminationszeit von Influenza-Aerosolen, die in einen Raum gehustet wurden, indem sie zwei Belüftungsszenarien mit den bekannten Auswirkungen der Feuchtigkeit auf die Virusinaktivierung, die Tröpfchen-Größenverteilung und die Absinkgeschwindigkeit kombinierten.
Wir erfahren, dass Feuchtigkeit eine entscheidende Rolle für die Beseitigung infektiöser Aerosole aus einem Raum spielt, wenn die Luftwechselrate niedrig ist (etwa 1/h), wie dies bei allen nicht mechanisch belüfteten Gebäuden der Fall ist. Wenn die relative Luftfeuchtigkeit von 10 auf 50% erhöht wird, verkürzt sich die Eliminationszeit für > 99,9% Elimination um 30% (100 min → 70 min, siehe Abbildung A).
Die Inaktivierung des Virus bei 50% relativer Luftfeuchtigkeit im Vergleich zu 30% relativer Luftfeuchtigkeit, erhöht die Eliminierungseffizienz um etwa 10%. Relevanter ist der Feuchtigkeitseffekt beim Absinken (durch Erhöhen des Tropfendurchmessers), da Absinken und –Sedimentation mehr als 80% der Eliminierungseffizienz ausmachen.
Die Belüftung ist am effektivsten zur Beseitigung kleiner Aerosole < 5 µm.
Diese Studie unterstreicht die Notwendigkeit, in öffentlichen Räumlichkeiten, insbesondere im Gesundheitswesen, in denen eine große Anzahl anfälliger und ansteckender Menschen zusammenkommen, eine optimale Luftfeuchtigkeit aufrechtzuerhalten.
Quellen
Originaltitel: Dynamics of airborne influenza A viruses indoors and dependence on humidity
Quellenlink: http://dx.doi.org/10.1371/journal.pone.00214815
Veröffentlicht: Juni 2011
1. Tamerius J, Nelson M, Zhou S, Viboud C, Miller M, et al. (2010) Global
influenza seasonality: Reconciling patterns across temperate and tropical
regions. Environ Health Perspect.
2. Hemmes JH, Winkler KC, Kool SM (1960) Virus survival as a seasonal factor in
influenza and poliomyelitis. Nature 188: 430–431.
3. Lowen AC, Mubareka S, Steel J, Palese P (2007) Influenza virus transmission is
dependent on relative humidity and temperature. PLoS Pathog 3: e151.
4. Steel J, Palese P, Lowen AC (2011) Transmission of a 2009 pandemic influenza
virus shows a sensitivity to temperature and humidity similar to that of an H3N2
seasonal strain. J Virol 85: 1400–1402.
5. Xie X, Li Y, Chwang ATY, Ho PL, Seto WH (2007) How far droplets can move
in indoor environments–revisiting the wells evaporation–falling curve. Indoor
Air 17: 211–225.
6. Chao CYH, Wan MP, Morawska L, Johnson GR, Ristovski ZD, et al. (2009)
Characterization of expiration air jets and droplet size distributions immediately
at the mouth opening. J Aerosol Sci 40: 122–133.
7. Effros RM, Hoagland KW, Bosbous M, Castillo D, Foss B, et al. (2002) Dilution of
respiratory solutes in exhaled condensates. Am J Respir Crit CareMed 165: 663–669.
8. Raphael GD, Jeney EV, Baraniuk JN, Kim I, Meredith SD, et al. (1989)
Pathophysiology of rhinitis. Lactoferrin and lysozyme in nasal secretions. J Clin
Invest 84: 1528–1535.
9. Seinfeld JH, Pandis SN (2006) Atmospheric chemistry and physics - from air
pollution to climate change. New York: John Wiley & Sons.
10. Shechmeister IL (1950) Studies on the experimental epidemiology of respiratory
infections: III. Certain aspects of the behavior of type A influenza virus as an airborne
cloud. J Infect Dis 87: 128–132.
11. Hemmes J, Winkler K, Kool S (1962) Virus survival as a seasonal factor in
influenza and poliomyelitis. Antonie Van Leeuwenhoek 28: 221–233.
12. Harper GJ (1961) Airborne micro-organisms: Survival tests with four viruses.
J Hyg 59: 479–486.
13. Schaffer FL, Soergel ME, Straube DC (1976) Survival of airborne influenza
virus: Effects of propagating host, relative humidity, and composition of spray
fluids. Arch Virol 51: 263–273.
14. Shaman J, Kohn M (2009) Absolute humidity modulates influenza
survival, transmission, and seasonality. Proc Natl Acad Sci USA 106:
3243–3248.
15. Loudon RG, Roberts RM (1967) Droplet expulsion from the respiratory tract.
Am Rev Respir Dis 95: 435–442.
16. Papineni RS, Rosenthal FS (1997) The size distribution of droplets in the
exhaled breath of healthy human subjects. J Aerosol Med 10: 105–116.
17. Yang S, Lee GWM, Chen C-M, Wu C-C, Yu K-P (2007) The size and
concentration of droplets generated by coughing in human subjects. J Aerosol
Med 20: 484–494.
18. Morawska L, Johnson GR, Ristovski ZD, Hargreaves M, Mengersen K, et al.
(2009) Size distribution and sites of origin of droplets expelled from the human
respiratory tract during expiratory activities. J Aerosol Sci 40: 256–269.
19. Xie X, Li Y, Sun H, Liu L (2009) Exhaled droplets due to talking and coughing.
J R Soc Interface 6: S703–S714.
20. Duguid JP (1946) The size and the duration of air-carriage of respiratory
droplets and droplet-nuclei. J Hyg 44: 471–479.
21. Tang JWT, Tambyah PA, Lai FYL, Lee HK, Lee CK, et al. (2010) Differing
symptom patterns in early pandemic vs seasonal influenza infections. Arch
Intern Med 170: 861–867.
22. Nicas M, Nazaroff WW, Hubbard A (2005) Toward understanding the risk of
secondary airborne infection: Emission of respirable pathogens. J Occup
Environ Hyg 2: 143–154.
23. Mikhailov E, Vlasenko S, Niessner R, Poschl U (2004) Interaction of aerosol
particles composed of protein and salts with water vapor: Hygroscopic growth
and microstructural rearrangement. Atmos Chem Phys 4: 323–350.
24. Posada JA, Redrow J, Celik I (2010) A mathematical model for predicting the
viability of airborne viruses. J Virol Methods 164: 88–95.
25. Tang IN, Tridico AC, Fung KH (1997) Thermodynamic and optical properties
of sea salt aerosols. J Geophys Res 102: 23269–23275.
26. Bagger H, Fuglsang C, Westh P (2006) Hydration of a glycoprotein: Relative
water affinity of peptide and glycan moieties. Eur Biophys J 35: 367–371.
27. Jensen MM (1964) Inactivation of airborne viruses by ultraviolet irradiation.
Appl Microbiol 12: 418–420.
28. Yamamoto N, Shendell DG, Winer AM, Zhang J (2010) Residential air
exchange rates in three major US metropolitan areas: Results from the
relationship among indoor, outdoor, and personal air study 1999–2001. Indoor
Air 20: 85–90.
29. Tompkins JA, White JA, Bozer YA, Tanchoco JMA (2010) Facilities planning:
John Wiley & Sons, Inc.
30. Myatt TA, Kaufman MH, Allen JG, MacIntosh DL, Fabian MP, et al. (2010)
Modeling the airborne survival of influenza virus in a residential setting: The
impacts of home humidification. Environ Health 9: 55.
31. Blachere FM, Lindsley WG, Pearce TA, Anderson SE, Fisher M, et al. (2009)
Measurement of airborne influenza virus in a hospital emergency department.
Clin Infect Dis 48: 438–440.
32. Lindsley WG, Blachere FM, Davis KA, Pearce TA, Fisher MA, et al. (2010)
Distribution of airborne influenza virus and respiratory syncytial virus in an
urgent care medical clinic. Clin Infect Dis 50: 693–698.
33. Yang W, Subbiah E, Marr LC (2011) Concentrations and size distributions of
airborne influenza A viruses measured indoors at a health centre, a day-care
centre, and on aeroplanes. J R Soc Interface. In press.
34. California Building Standards Commission (2007) 2007 California mechanical
code (part 4, title 24, California code of regulations).
35. McDevitt J, Rudnick S, First M, Spengler J (2010) Role of absolute humidity in
the inactivation of influenza viruses on stainless steel surfaces at elevated
temperatures. Appl Environ Microbiol 76: 3943–3947.
36. Brown JD, Goekjian G, Poulson R, Valeika S, Stallknecht DE (2009) Avian
influenza virus in water: Infectivity is dependent on pH, salinity and
temperature. Vet Microbiol 136: 20–26.
37. Parker ER, Dunham WB, MacNeal WJ (1944) Resistance of the melbourne
strain of influenza virus to desiccation. J Lab Clin Med 29: 37–42.
38. Thomas Y, Vogel G, Wunderli W, Suter P, Witschi M, et al. (2008) Survival of
influenza virus on banknotes. Appl Environ Microbiol 74: 3002–3007.
39. Oberdorster G, Oberdorster E, Oberdorster J (2005) Nanotoxicology: An
emerging discipline evolving from studies of ultrafine particles. Environ Health
Perspect 113: 823–839.
40. Lowen AC, Steel J, Mubareka S, Palese P (2008) High temperature (30uC)
blocks aerosol but not contact transmission of influenza virus. J Virol 82:
5650–5652.
41. Lowen A, Palese P (2009) Transmission of influenza virus in temperate zones is
predominantly by aerosol, in the tropics by contact: A hypothesis. PLoS Curr 1:
RRN1002.
42. Fischer H, Widdicombe JH (2006) Mechanisms of acid and base secretion by the
airway epithelium. J Membr Biol 211: 139–150.
43. Enberg N, Alho H, Loimaranta V, Lenander-Lumikari M (2001) Saliva flow
rate, amylase activity, and protein and electrolyte concentrations in saliva after
acute alcohol consumption. Oral Surg Oral Med Oral Pathol Oral Radiol
Endod 92: 292–298.
44. Michishige F, Kanno K, Yoshinaga S, Hinode D, Takehisa Y, et al. (2006) Effect
of saliva collection method on the concentration of protein components in saliva.
J Med Invest 53: 140–146.
45. Lai ACK, Cheng YC (2007) Study of expiratory droplet dispersion and transport
using a new eulerian modeling approach. Atmos Environ 41: 7473–7484.
46. Fabian P, McDevitt JJ, DeHaan WH, Fung ROP, Cowling BJ, et al. (2008)
Influenza virus in human exhaled breath: An observational study. PLoS ONE 3:
e2691.
47. Douglas Jr. RG (1975) Influenza in man. In: Kilbourne ED, ed. The influenza
viruses and influenza. New York: Academic Press. pp 395–447.
48. Lindsley WG, Blachere FM, Thewlis RE, Vishnu A, Davis KA, et al. (2010)
Measurements of airborne influenza virus in aerosol particles from human
coughs. PLoS ONE 5: e15100.
49. Murphy BR, Rennels MB, Douglas RG, Jr., Betts RF, Couch RB, et al. (1980)
Evaluation of influenza A/Hong Kong/123/77 (H1N1) ts-1A2 and coldadapted
recombinant viruses in seronegative adult volunteers. Infect Immun 29:
348–355.
50. Ward CL, Dempsey MH, Ring CJA, Kempson RE, Zhang L, et al. (2004)
Design and performance testing of quantitative real time PCR assays for
influenza A and B viral load measurement. J Clin Virol 29: 179–188.
51. Hinds WC (1999) Aerosol technology. 2nd ed. New York: Wiley. pp 75–110.
Studie Ajit Ahlawat
Die Übertragung des schweren akuten respiratorischen Syndroms Coronavirus 2 (SARS-CoV-2) durch die Luft wurde als potenzielle Pandemieherausforderung...
Einfluss der Luftfeuchte auf Mensch und Gesundheit
In der wissenschaftlichen Literatur werden unterschiedliche Empfehlungen für untere und obere Grenzwerte der relativen Luftfeuchte für Innenräume gen...
Auswirkungen von Umweltfaktoren auf COVID-19
Auswirkungen von Umweltfaktoren auf den Schweregrad und die Sterblichkeitsquote von COVID-19.
Saisonalität der respiratorischen viralen Infektionen
Der saisonale Zyklus von respiratorischen Virusinfektionen ist seit Tausenden von Jahren bekannt. Jahr für Jahr wird die Bevölkerung der gemäßigten K...
Luftfeuchtigkeit in Schulklassen
Influenza ist ein globales Problem und betrifft jährlich 5–10 % der Erwachsenen und 20–30 % der Kinder. Nicht-pharmazeutische Interventionen (NPIs) s...
COVID-19: Reduzierung der Übertragung
Aufgrund der weltweit zunehmenden Infektionen mit dem schweren akuten respiratorischen Coronavirus-2-Syndrom (SARS-CoV-2), das die Coronavirus-Krankh...
Überlebensfähigkeit von Coronaviren
In dieser Studie wurden die Auswirkungen der Lufttemperatur und der relativen Luftfeuchtigkeit auf das Überleben von Coronaviren auf Oberflächen unte...
Optimale Raumluftfeuchte
Optimale Luftfeuchte in Räumen ist notwendig, um das Wohlbefinden des Menschen zu steigern, aber im Gegensatz zu den meisten anderen Schadstoffen in ...
Auswirkung auf das Sick-Building-Syndrom
Das Ziel dieser Studie war die wissenschaftliche Auseinandersetzung der Auswirkungen von Dampfluftbefeuchtung auf das Sick-Building-Syndroms (SBS) un...
Das saisonale Auftreten von Influenza Viren
Die im Winter beobachtete gesteigerte Sterblichkeit in gemäßigten Zonen wird zu großen Teilen der saisonalen Influenza zugeschrieben. Eine Reanalyse ...